Е.Е. ГЕНРИХС, В.И. ДЕМИДОВ, А.Ю. ВОЛКОВ, Г.Л. ХАСПЕКОВ, О.П. АЛЕКСАНДРОВА
Цель исследования: Изучение синергизма между нейропептидами церебролизина и ионами лития. Материал и методы. Экспериментальная модель инсульта (хроническая двусторонняя окклюзия общих сонных артерий у крыс), исследования на нейронах в культуре, гистоморфологические анализы, исследования микроэлементного профиля биосубстратов мозга.
Результаты: Проведенный комплекс экспериментальных исследований показал существование синергизма между ионами лития и нейропептидами в составе церебролизина. Фармакокинетический синергизм заключается в ускоренном накоплении лития в тканях головного мозга под воздействием церебролизина. Существование фармакодинамического синергизма между нейропептидами в составе церебролизина и литием следует из установленного нами потенцирования нейропротективных эффектов препарата под воздействием ионов лития на модели инсульта. Заключение. Ионы лития потенцируют нейропротективные эффекты церебролизина.
Ключевые слова: нейропептиды, литий, гистология, нейроцитология, модель хронической двусторонней окклюзии общих сонных артерий.
Церебролизин, действующим началом которого является пептидный экстракт мозга молодых свиней, используется для восстановления неврологических функций у пациентов с инсультом, травмой мозга, деменцией. В его состав входят пептиды с низкой молекулярной массой — более 95% — молекулы с массой менее 6000 Да и менее 5% — с массой 6000—10000 Да [1]. Такие пептиды способны преодолевать гематоэнцефалический барьер (ГЭБ) и поступать в нейроны. Применение церебролизина при инсульте и черепно-мозговой травме достоверно уменьшает неврологический дефицит [2], улучшает когнитивные способности [3], восстанавливает биоэлектрическую активность мозга [4], снижает объем зоны инфаркта [5]. Церебролизин оказывает нейрорегенеративное воздействие [6], уменьшая нарушения структуры нейронов [7], снижает когнитивную дисфункцию на моделях диабета, снижая уровень провоспалительного фактора некроза опухоли (ФНО-α) и повышая — инсулиноподобного гормона роста IGF-1, серотонина, а также оказывает антиоксидантное действие [8].
Нами изучались различные свойства церебролизина, включая состояние мембранной фракции [9], витаминную активность [10], аминокислотный [1], микроэлементный [11] и пептидный составы [12]. Анализ препарата позволил установить наличие активных пептидных фрагментов фактора роста нервов (ФРН) и ряда нейротрофических пептидов, стимулирующих регенерацию нейронов, рост аксонов и другие аспекты функционирования нейронов. Показано, что в его состав входят нейропептиды, являющиеся биологически активными фрагментами ростовых факторов нервной ткани. В состав легкой пептидной фракции церебролизина (до 1500 Да) входят активные фрагменты ФРН, энкефалинов, тиролиберина, орексина и галанина. Анализ их молекулярно-фармакологического действия показал перспективность исследований синергичных эффектов между нейроактивными пептидами церебролизина и нейроактивными микронутриентами [12]. Установленное в эксперименте повышение активности сигнального каскада Shh под воздействием церебролизина связано с потенцированием пептидными фрагментами ФРН действия витамин-А-зависимых рецепторов ретиноидов, стимулируюших долговременный рост нейритов.
Литий способствует повышению скорости роста нейронов и обеспечению устойчивости к окислительному стрессу [13], улучшению пространственной памяти, предотвращению негативного влияния хронического стресса [14]. Назначение лития вызывает увеличение объема серого вещества [15]. Хотя в большинстве экспериментов использовались концентрации 0,2—0,5 мМ, нейропротективный эффект может наблюдаться при гораздо меньших концентрациях (0,01—0,1 мМ) [16]. Нейротрофические эффекты возникают за счет увеличения экспрессии нейротрофических факторов [17].
Проведенные нами ранее экспериментальные исследования показали существование синергизма между литием и активными нейропептидами церебролизина [18]. Следует отметить, что через ГЭБ в первую очередь проникают молекулы с меньшей молекулярной массой (несколько тысяч Да). Поэтому для адекватного моделирования терапевтического процесса в экспериментах in vitro и in vivo мы использовали экстракт легких пептидных фракций церебролизина (до 1500 Да), в состав которого и входят фрагменты ФРН, энкефалинов, орексина и галанина. Цель исследования — изучение синергизма церебролизина и нейроактивного микроэлемента лития.
Материал и методы
Экспериментальные исследования
Работа выполнена на 60 взрослых белых крысах-самцах массой 200—300 г, которые содержались в пластиковых клетках изолированно друг от друга при естественном освещении, температуре воздуха около 20—22 °С, свободном доступе к пище и воде. Критериями отбора животных, наряду с массой тела и полом, являлись их общее состояние, активное поведение, гладкая блестящая шерсть и чистый кожный покров, отсутствие внешних признаков заболеваний. Экспериментальные животные были рандомизированы на шесть групп (по 10 животных в каждой группе): 1-я группа — интактный контроль, 2-я группа — интактные животные, получавшие церебролизин внутрибрюшинно; 3-я группа — интактные животные, получавшие церебролизин интраназально; 4-я группа — животные с моделью хронической двусторонней окклюзии общих сонных артерий, получавшие плацебо; 5-я группа — животные с моделью хронической двусторонней окклюзии общих сонных артерий, получавшие церебролизин внутрибрюшинно; 6-я группа — животные с моделью хронической двусторонней окклюзии общих сонных артерий, получавшие цитрат лития перорально (30 мкг/кг). Всем экспериментальным животным было проведено неврологическое тестирование.
Животным 2-й, 3-й и 5-й групп церебролизин вводили внутрибрюшинно (215 мг/кг/сут), 3-й группы— интраназально в течение 14 сут, а животные 6-й группы получали цитрат лития в течение 30 сут. Затем вновь выполнялось неврологическое тестирование, после которого у животных 4-й и 5-й групп воспроизводили модель хронической двусторонней окклюзии общих сонных артерий. Через 14 дней выполнялось заключительное неврологическое тестирование, затем крысы подвергались эвтаназии посредством хлоралгидрата (700 мг/кг) для проведения патогистологического исследования и анализа содержания микроэлементов в ткани головного мозга. Оценку сложного двигательного поведения проводили по методике D. Combs и L. D’Alecy [19], включающей тесты с наклонной проволочной платформой, удержания равновесия на горизонтальном стержне, подвешивания на горизонтально натянутой проволоке.
Модель хронической двусторонней окклюзии общих сонных артерий
В данной модели наблюдалось снижение кровотока лишь до 30% от исходного; выживаемость составляла 75— 80% [20]. У большинства выживших животных в остром периоде отмечался небольшой неврологический дефицит, так что модель применима для оценки начальных дегенеративных изменений головного мозга. Животным под наркозом (хлоралгидрат, 300 мг/кг внутрибрюшинно) проводился разрез мягких тканей передней поверхности шеи, после чего с обеих сторон выделялись и перевязывались общие сонные артерии и раны послойно ушивали. Операция занимала 4—6 мин.
Патогистологическое исследование
После декапитации выполнялось исследование полости черепа и выделение головного мозга на уровне ствола. В течение 2 сут головной мозг фиксировался в 10% растворе забуференного формалина, затем рассекался на пластины толщиной 3 мм во фронтальной плоскости с выделением зоны операционного повреждения. После обезвоживания в этиловом спирте и ксилоле изготавливались парафиновые блоки. Патогистологическое исследование проводилось на серийных срезах толщиной 5—6 мкм, которые окрашивались гематоксилином и эозином, реактивом Шиффа (ШИК-реакция). Микрофотографии были получены с помощью исследовательского микроскопа «Micros» на анализаторе изображений BioVision (Австрия).
Исследования на культуре нейронов
Использовались 7—8-суточные культуры, полученные методом ферментно-механической диссоциации клеток мозжечка 7-дневных крыс. Через 5 мин после наступления смерти крысы стерилизовались 70% спиртом, быстро вскрывался череп, извлекался мозжечок и помещался в пластиковую чашку Петри, заполненную фосфатным буфером, лишенным ионов кальция и магния. Фрагменты ткани инкубировали 15 мин при 37 оС в фосфатном буфере, содержащем 0,05% трипсина, 0,02% ЭДТА и 0,8% глюкозы.
После инкубации ткань промывали в двух сменах фосфатного буфера и один раз средой культивирования и подвергали механической диссоциации в питательной среде для культивирования, в состав которой входят 90% среды Игла, 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 5 мМ KCl и 10 мМ буфера НЕРЕS, pH 7,2—7,4.
Суспензию клеток центрифугировали 1 мин при 1000 об/мин, супернатант удаляли, а осадок ресуспендировали в питательной среде. Культивирование производили в 96-луночных пластиковых планшетах, покрытых полиэтиленимином или полилизином, в питательной среде с уровнем KCl 25 мМ. В каждую ячейку планшета добавляли по 0,1 мл суспензии клеток. Культивирование производили 7—8 суток в инкубаторе, заполненном газовой смесью (95% воздуха + 5% СО2), при температуре 35,5 оС и относительной влажности 98%. К этому сроку культивированные зернистые нейроны (КЗН) достигают своей
морфологической и нейрохимической зрелости. Состояние культур контролировали ежедневно и на каждом этапе эксперимента путем визуального просмотра в инвертированном микроскопе при фазовом контрасте. Вещества добавляли в среду культивирования на 2-е сут на весь срок культивирования (до 7 сут). Исходя из концентрации вещества в пробирке (10 мМ), его минимально возможное разведение для добавления к культурам 1:10, чтобы сохранить необходимые свойства питательной среды, т.е. 1 мМ. Для анализа были выбраны следующие концентрации: 0,1; 0,2; 0,5; 1,0 мМ. Количественную оценку выживаемости клеток производили с помощью прямого подсчета живых нейронов. Клетки-зерна идентифицировались как небольшие, 7—10 мкм в диаметре, округлые или овальные нейроны. При окраске фиксированных культур трипановым синим хорошо видны ядра КЗН, занимающие большую часть тел нейронов, и окруженные тонким ободком цитоплазмы (рис. 1).
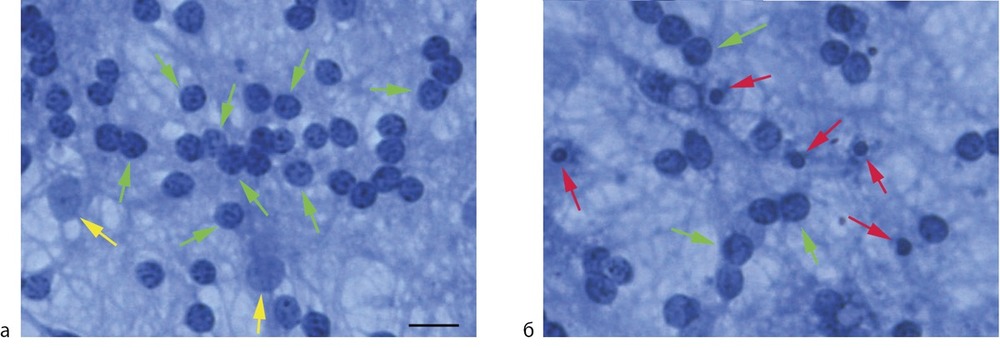
Рис. 1. Первичная диссоциированная фиксированная культура клеток мозжечка, окрашенная трипановым синим.
а — контроль, б — обработка 24 ч глутаматом. Зеленые стрелки указывают на зернистые нейроны с нормальной морфологией, желтые — на ядра глиальных клеток, красные показывают пикнотические ядра погибших нейронов, масштаб 15 мкм.
Для каждого вещества было выполнено как минимум 3 эксперимента, на каждую точку брали по 3 культуры, в каждой из которых фотографировали и просчитывали по 5 последовательных полей зрения (как минимум 45 полей зрения из 9 культур трех независимых экспериментов). Количество нейронов с неизмененной морфологией в контрольных культурах принимали за 100% выживаемости. Для статистического анализа использовали тест ANOVA с поправками Бонферрони—Даннетта. Отличия между группами считались достоверными при p<0,05. Результаты выражали как среднее ± стандартное отклонение.
Было выполнено моделирование повреждения культур нейронов глутаматом («Sigma», США, N.G-1626), который оказывал дозозависимый токсический эффект. Выбор концентрации (из 3 использованных) проводили в каждом опыте таким образом, чтобы выживаемость КЗН составляла 30—80% от контроля. Именно такая выживаемость позволяет выявлять действие различных веществ на процесс гибели клеток. При выживаемости менее 30 или более 80% нейропротективные эффекты могут не проявиться. В дальнейших исследованиях использовали подсчет клеток при действии предполагаемых нейропротекторов, добавляя в среду токсические концентрации глутамата (100—500 мкМ). Проводились очистка препарата, затем хроматографическое выделение легкой пептидной фракции. Очистка состояла в отделении липидной фракции и обессоливании. Для этого использовался модифицированный метод Брокерхоффа—Даусона—Хюбшера [21]. Сначала проводили мягкое щелочное дезацилирование фосфолипидов. Методику отрабатывали на смеси 1 мл протеолипосом из 1—20 мг фосфатидилхолина и 0,05—0,2 мг бацитрацина или грамицидина А; 1 мл образца очищенного церебролизина-1 лиофилизировали, доливали гексан, метанол (1:1) и разводили в 2 раза 0,25 М NaOH в метаноле. 45 мин инкубировали при встряхивании при комнатной температуре, включая 15 мин — при 75 °C. Последовательно приливали метанол, гексан и воду (1:4:4), перемешивали и центрифугировали 1 мин при 1000 g. Фракцию с гексаном отсасывали, водно-метанольную — нейтрализовали HCl до pH 4—6. К нейтрализованной водно-метанольной фракции добавляли гексан, перемешивали, центрифугировали 1 мин при 1000 g, осторожно отсасывали фракцию с гексаном, не затрагивая осадок на границе раздела фаз. Повторяли процедуру 4 раза. Водно-метанольную фракцию объединяли, лиофилизировали, осадок ресуспендировали сначала в смеси метанол: вода (1:1), супернатант сливали, затем в смеси хлороформ: метанол (1:1), 0,2% ТФУ, супернатанты объединяли, высушивали и обессоливали.
Обессоливание пептидов проводили на мини-колонке 0,75×4,5 см («Raining Instrument», США) при помощи центрифугирования [22]. В колонку наливали 2 мл сефадекса G-10 («Pharmacia», Швеция), декантированного в смеси метанол: вода (85:15), каплями наливали 160 мкл того же раствора и уравновешивали на центрифуге 1 мин при 1000 g. Процедуру повторяли до тех пор, пока на выходе не оставалось 150 мкл раствора. 160 мкл образца каплями наносили на гель и центрифугировали, как описано выше. Гель после однократного использования заменяли. После процедуры обессоливания потери белка составляли не более 35%. Хроматографическое разделение пептидной фракции проводилось с использованием ВЭЖХ хроматографа AGILENT на колонке Диасорб С16Т («Элсико», Россия) [23]. Скорость потока составила 0,8 мл/мин, объем образца: 50—1000 мкл при температуре 20 °С. Детекция фракций проводилась посредством УФ-детектора на частоте волны 214 нм, отбирались фракции с молекулярными массами до 1500 Да.
Получение масс-спектров пептидной фракции
Масс-спектры получали на приборе Reflex IV («Bruker», Германия) MALDI-TOF в рефлекторном режиме, используя азотный лазер с длиной волны 337 нм и частотой импульса 9 Гц в режиме положительных ионов. Время задержки анализатора — 200 нс, напряжения на электроде ускорителя — 20,0 кВ, накапливающем электроде — 16,5 кВ, фокусирующей линзе — 9,5 кВ, рефлекторе — 23,0 кВ. Полученные масс-спектры пептидов дополнительно калибровали по внутренним стандартам по известным массам [24]. Каждый масс-спектр получали усреднением 300 накоплений с разных точек образца при мощности лазерного излучения на уровне порогового значения. Для всех образцов использовали в качестве матрицы 65 мМ раствор 2,5-дигидроксибензойной кислоты («Fluka», Германия) в 20% ацетонитриле с добавлением 0,1% трифторуксусной кислоты («Merck», Германия). Лиофилизированные пептиды растворяли в 10 мкл 50% ацетонитрила с добавлением 0,1% трифторуксусной кислоты; 0,3 мкл образца наносили на мишень («Bruker Daltonic», Германия), добавляли 0,3 мкл раствора матри-цы и высушивали на воздухе. Для рекристаллизации добавляли 1—2 раза по 0,3 мкл раствора матрицы с промежуточной просушкой на воздухе до получения видимых при 10-кратном увеличении кристаллов. Все использованные растворители, включая воду («Merck», Германия), были только аналитической чистоты или специальные (для масс-спектрометрии).
Анализ микроэлементного состава легкой пептидной фракции церебролизина
Элементный анализ церебролизина проводился методом масс-спектрометрии. Образцы разбавляли бидистиллированной водой в соотношении 1:3 по объему. В качестве внутреннего стандарта в растворы вводили индий в концентрации 25 мкг/л. Калибровочные растворы были приготовлены из стандартных растворов фирмы «Merck» с известным содержанием в диапазоне от 5—1000 мгк/л (7—10%). Полученные растворы анализировались на масс-спектрометре с ионизацией в индуктивно-связанной плазме «VG Plasma Quad PQ2 Turbo» (Англия), рабочая мощность СВЧ-генератора 1,3 кВт, расход плазмообразующего газа (аргон) 14 л/мин, расход транспортирующего газа 0,89 мл/мин, для определения щелочных металлов расход — 1,05 мл/мин. Проводилось 3 экспозиции каждого образца, время интегрирования сигнала 60 с. Результаты анализа «холостой пробы» автоматически вычитались в анализе. Единицы измерения — мкг/кг (ppb).
Определение содержания микроэлементов в мозге у крыс
С помощью одноразовых пластиковых минипинцетов и скальпелей («Perkin Elmer») забирались образцы из 5 областей мозга животных: лобной, височной, теменной долей, мозжечка и промежуточного мозга. Образцы сохранялись в промаркированных пакетах в жидком азоте до момента проведения масс-спектрометрического исследования. Затем полученные образцы высушивались при температуре 105 °C в сушильном шкафу в течение 6 ч. После этого они взвешивались на аналитических весах AD-6 Autobalance («Perkin Elmer») с точностью до 0,1 мг. Навески материала переносились в автоклав и к ним добавлялся 1 мл 70% HNO3. Затем автоклав помещался в микроволновую систему подготовки проб MD-2000 («CEM», США), которая устойчиво обеспечивала достаточно высокое давление и температуру кипения HNO3. После охлаждения образца в течение 10 мин в автоклав добавляли 1 мл Н2О2 (24%) особого чистого вещества (ОСЧ). После охлаждения в течение 60 мин полученных растворов от них в пластиковые сосуды отбирались образцы в объеме 1 мл, которые разбавлялись в 5 раз бидистиллированной и деионизированной водой. Для контроля чистоты анализа отдельно был приготовлен раствор «холостой пробы» с содержанием HNO3, H2O2, H2O в пропорциях, идентичных их содержанию в исследуемых образцах. Описанная выше методика подготовки с использованием СВЧ-нагрева в тефлоновых «бомбах» позволяет проводить быстрое вскрытие биопробы, избежать потерь летучих элементов (As, Se и др.), с высокой эффективностью разложить биологическую матрицу, влияющую на результаты анализа. Полученные растворы анализировались на масс-спектрометре с ионизацией в индуктивно-связанной плазме VG Plasma Quad PQ2 Turbo (Англия). В качестве внутреннего стандарта в растворы вводили индий в концентрации 25 мкг/л. Калибровочные растворы были приготовлены из стандартных растворов производства VTRC с известным содержанием в диапазоне от 5—1000 мгк/л. Рабочая мощность СВЧ-генератора была 1,3 кВт. Расход плазмообразующего газа (аргон) — 14 л/мин, расход транспортирующего газа — 0,89 мл/мин. Проводилось 3 экспозиции каждого образца, время интегрирования сигнала 60 с.
Результаты и обсуждение
Результаты количественной оценки пептидного состава легкой пептидной фракции церебролизина
Масс-спектрограмма пептидной фракции показала, что в препарате не содержится пептидов с молекулярной массой более 10 000 Да, а 95% пептидов имеют массу до 6000 Да [1, 9]. Принимая во внимание, что площадь масс-спектра соответствует 15% сухого остатка, масс-спектрограмма позволяет оценить содержание в его составе активных пептидов GEFSV (607 Да) и NSYCTTT (820 Да) ФРН, энкефалин-эндорфиновых пептидов YGGFL (588 Да), GGFLR (582 Да), YGGFM (606 Да), активных пептидов орексина CCRQK (670 Да) и галанина WWLNSAGY (1024 Да) [9, 12].
Проведенный анализ показал, что изучаемые нейропептиды присутствуют в составе препарата в наномолярных концентрациях. При назначении церебролизина по 10 мл/сут, с учетом объема крови человека (4—6 л), их концентрации в крови будут в 1,5—2 выше.
Легкая пептидная фракция церебролизина сохраняет нейропротективные свойства
Через 2 нед после воспроизведения модели ишемического повреждения головного мозга в 4-й и 5-й группах было выявлено снижение показателей сложного двигательного поведения, определяемых как сумма баллов по шкале Combs и D’Alecy в отдельных тестах. Общая сумма баллов была значимо выше в 5-й группе по сравнению с контролем: в 5-й группе — 8,2±0,6; в 4-й группе — 5,0±1,6 (p<0,008). В контрольной группе отмечено также значимое ухудшение выполнения животными тестов с наклонной проволочной платформой (p<0,05) и удержания на горизонтальном стержне (p<0,01). В 5-й группе, несмотря на снижение общей суммы баллов, достоверно ухудшилось лишь выполнение теста подтягивания (p<0,05). Тест удержания на наклонной платформе животные данной группы также выполняли значительно лучше, чем в контроле (p<0,002). Таким образом, результаты тестирования указывают на снижение неврологического дефицита у животных при применении церебролизина.
Эксперименты на КЗН мозжечка показали, что в 7-суточных культурах, не обработанных глутаматом, при действии церебролизина выживаемость нейронов не изменяется по сравнению с контролем, где вместо исследуемого вещества вносили фосфатный буфер.
При действии церебролизина на нейроцитотоксичность глутамата выявлен достоверный защитный эффект. Выживаемость нейронов при воздействии глутамата составила 45,1±2,1%, а глутамата с церебролизином при разведении в 5000—10 000 раз (0,1—0,2 мл церебролизина на 1 л дистиллированной воды) выживаемость составила 53,0±2,8 и 51,5±2,8% соответственно (рис. 2, 3). Таким образом, церебролизин достоверно повышает выживаемость нейронов, в среднем, на 8±3% (p<0,05) в условиях избытка глутама (200 мкмоль/л).
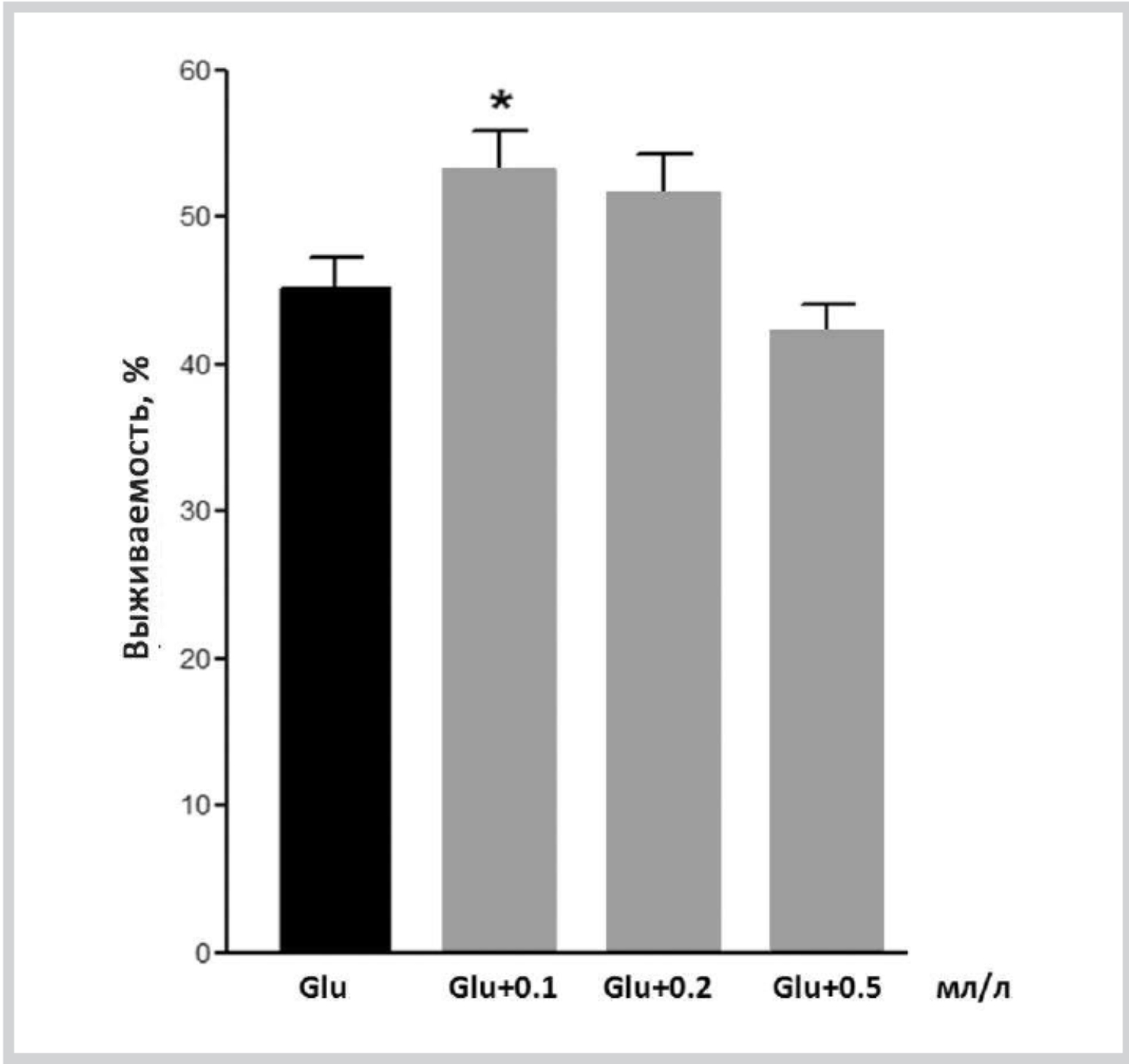
Рис. 2. Влияние церебролизина на выживаемость культур при действии избытка глутамата.
Glu — глутамат (200 мкмоль/л); Glu+0,1 мл/л — глутамат с легкой пептидной фракцией в разведении, соответствующем 0,1 мл препарата церебролизина на 1 л дистиллированной воды, где n=45 — количество просчитанных полей зрения (* — p<0,05).
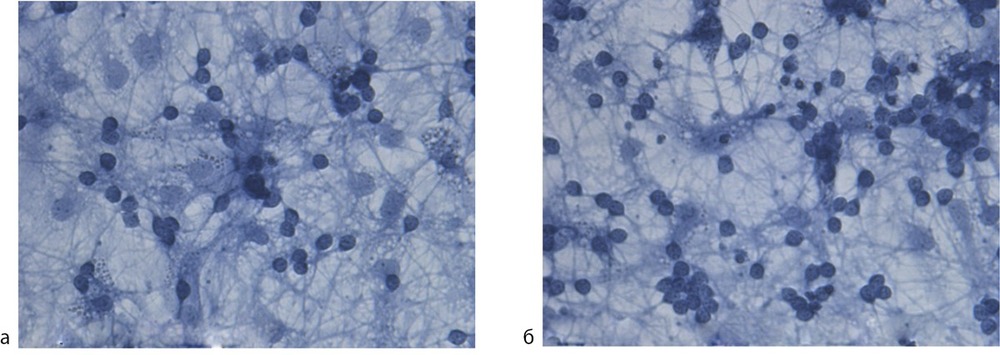
Рис. 3. Пример воздействия церебролизина на выживаемость культуры нейронов при токсическом воздействии глутамата.
Диссоциированная фиксированная культура окрашена трипановым синим. Ув. 1000; а — глутамат, 200 мкмоль/л. Отмечается небольшое количество выживших зернистых нейронов с нормальной морфологией; б — клетки выращенные с церебролизином в течение 5 сут в концентрации, соответствующей разведению препарата 0,1 мл/л обработка проводилась глутаматом, 200 мкмоль/л. Видно большее количество выживших зернистых нейронов с нормальной морфологией.
Существование нейропротективного эффекта было подтверждено и при добавлении церебролизина на 6-е сутки культивирования, т.е. всего за 24 ч до токсического воздействия глутамата. И в этом случае был выявлен защитный эффект при разведении церебролизина в 10 000 раз (0,1 мл/л) (рис. 4). Полученные нами данные согласуются с in vitro исследованиями B.Hutter-Paier et at., в которых Церебролизин предотвращал опосредованное L-глутаматом повреждение нейронов [35].
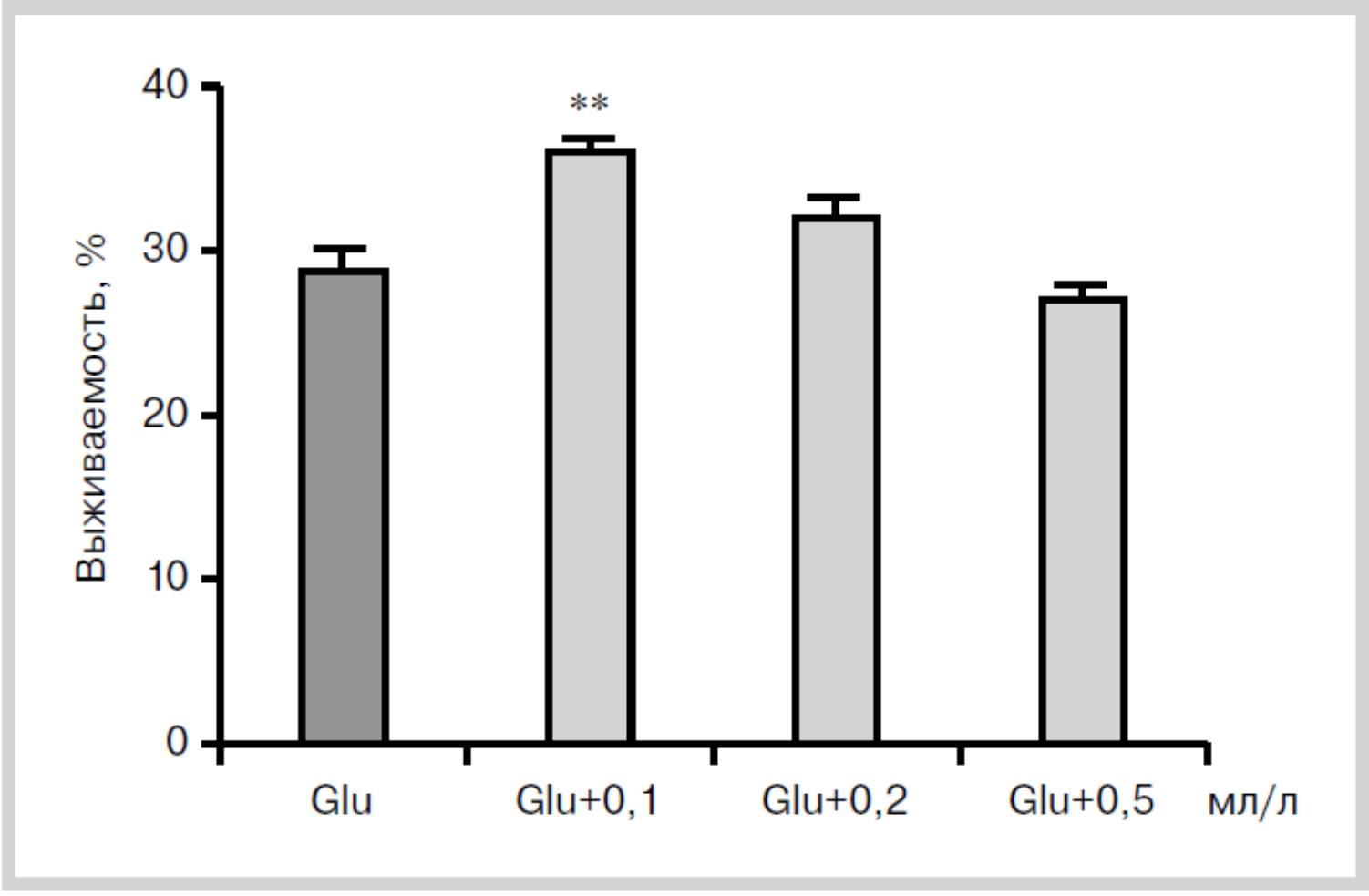
**p<0,01, n=15, где n количество просчитанных полей зрения
Результаты неврологического тестирования и исследования выживания нейронов в культуре подтверждаются гистологическим анализом образцов ткани мозга животных 4-й и 5-й групп. Гистоморфологические исследования показали, что в контроле (4-я группа) в краях разреза головного мозга наблюдается повсеместное повреждение нейроцитов, среди которых преобладали «темные» (пикноморфные) формы (рис. 5, а, см. на цв. вклейке). Макрофагальная реакция хорошо выражена, с образованием «зернистых шаров», заметно образование микрокист. Зона некроза обильно инфильтрирована лимфоцитами, инфильтрат в основном состоял из плазматических клеток (см. рис. 5, б, см. на цв. вклейке). В 5-й группе в большинстве наблюдений отмечается частичная гибель нейронов на фоне таких признаков необратимых изменений, как гиперхроматоз ядра, хроматолиз и вакуолизация цитоплазмы. Выявлялось значительное количество нейронов с признаками обратимости ишемических изменений (побледнение ядерной мембраны и помутнение нуклеоплазмы, см. рис. 5, в, см. на цв. вклейке). Лимфоцитарная провоспалительная инфильтрация имела очаговый характер (см. рис. 5, г, см. на цв. вклейке).
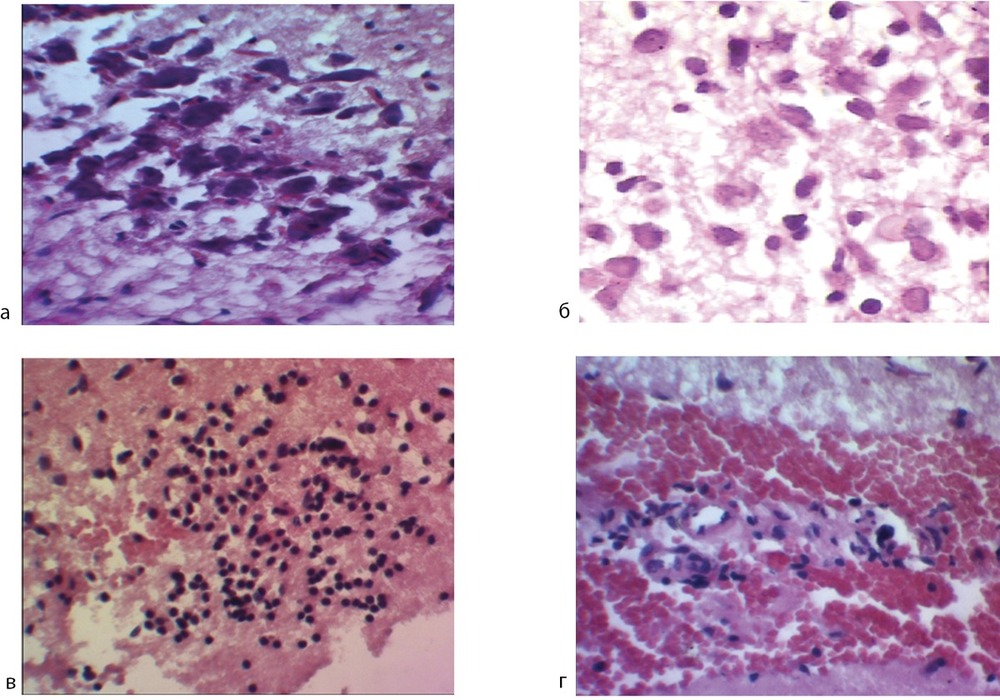
Рис. 5. Гистоморфологический анализ влияния церебролизина на состояние ткани мозга экспериментальных животных.
Окраска гематоксилином и эозином, ув. 350; а — скопление «темных» нейронов с необратимыми изменениями; б — выраженная лимфоцитарная инфильтрация; в — «светлые» типы поврежденных нейронов (обратимые изменения); г — слабая лимфоцитарная инфильтрация.
Таким образом, при исследовании головного мозга крыс, получавших церебролизин, выявлена повышенная устойчивость нейронов к повреждению. Характер гибели нервных клеток с преобладанием «светлых» форм свидетельствует о задержке развития необратимой стадии некроза.
Анализ содержания микроэлементов в легкой пептидной фракции церебролизина подтвердил, что процесс фракционирования не нарушил степень очистки препарата и не привнес в состав экстракта новых микроэлементов. Суммарное содержание токсических и условно-токсических элементов в легкой пептидной фракции составило менее 0,35 мкг/кг, а в церебролизине — 0,44 мкг/кг, причем в составе экстракта не было обнаружено токсических Cd, Tl, Pb, Bi, Th, U, Be, Ti, Ni [26]. Анализ содержания лития, магния, селена подтвердил, что в экстракте пептидной фракции эти элементы содержатся в очень малых количествах (суммарно, менее 100 мкг/кг). Содержание лития составило всего 5,6±2,2 мкг/кг, что не является достаточным для проявления его нейропротекторных свойств. Этот результат также подтверждает, что оказываемый церебролизином эффект на накопление лития в коре мозга обусловлен именно пептидным/аминокислотным составом препарата. Анализ содержания лития в коре головного мозга показал, что внутрибрюшинное и, в особенности, интраназальное введение церебролизина приводило к достоверному повышению его содержания в коре мозга (рис. 6). Во 2-й группе концентрация лития в коре повышалась на 42±22 мкг/кг (p=0,0058), а в 3-й — на 59±20 мкг/кг по сравнению с контролем (р=0,0014). Различия между 2-й и 3-й группами не носили достоверного характера (р=0,08).
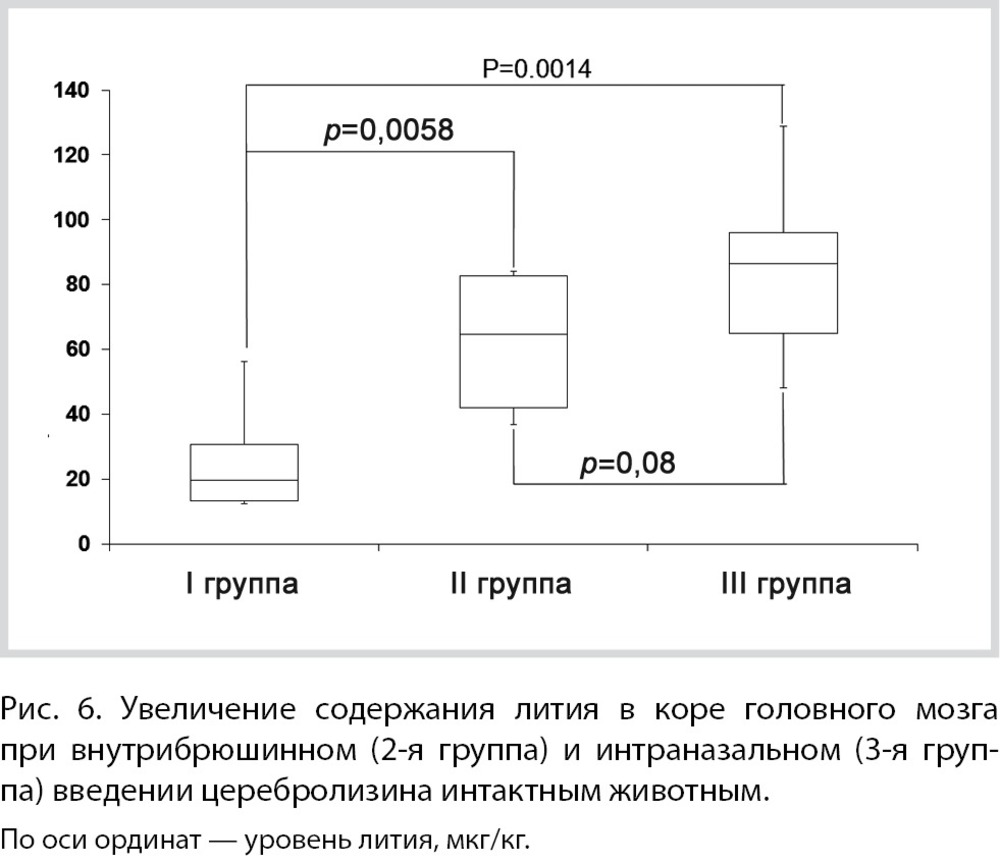
В соответствии с результатами анализа микроэлементного состава церебролизина, содержащееся в нем количество лития недостаточно для столь выраженного увеличения его концентрации в головном мозге. Вероятно, нейропептиды церебролизина стимулируют перераспределение лития в организме в пользу нервной ткани. Можно также предположить, что происходит более эффективное усвоение лития, поступающего в организм с пищей и с водой. Кроме биологически активных нейропептидов в церебролизине в значительном количестве присутствуют аминокислоты (75%), обладающие нейропротективным и нейротрофическим действием (регуляция уровня глутамата, модуляция NMDA-рецепторов и ингибирование эксайтотоксичности, антиоксидантные эффекты и др.) [1]. Помимо этого, аминокислоты также являются транспортерами катионов внутрь клеток. Можно предположить, что присутствие аминокислот в составе церебролизина способствует более активному транспорту лития из крови в цереброспинальную жидкость (ЦСЖ), а из ЦСЖ — внутрь нейронов.
Для количественной оценки неврологического дефицита в модели хронической двусторонней окклюзии общих сонных артерий (4-я и 6-я группы) проводилось исследование сложного двигательного поведения в тесте Combs и D’Alecy. До создания ишемии средняя оценка по тесту не отличалась между 4-й и 6-й группами. Показатели отдельных тестов (наклонная платформа, горизонтальный стержень, подтягивание на проволоке) также не имели значимых различий между изучаемыми группами. На 7-й день ишемии в обеих группах было выявлено снижение средних значения теста. Во всех группах снизился интегральный показатель сложного двигательного поведения, определяемый как сумма баллов в отдельных тестах. В большей степени ухудшилось выполнение животными теста подтягивания на горизонтально натянутой проволоке. В 4-й группе значения снизились до 5,0±1,6, а в 6-й группе — до 8,3±1,0 балла (р=0,007; t-тест). В контроле отмечено значимое ухудшение выполнения животными тестов с наклонной проволочной платформой и удержания на горизонтальном стержне. В 6-й группе, несмотря на снижение общей суммы баллов, отмечено значимое ухудшение только выполнения теста подтягивания, а снижения показателей в остальных тестах зафиксировано не было. Выявленные изменения свидетельствуют о меньшем неврологическом дефиците у животных, получавших цитрат лития, до создания хронической двусторонней окклюзии общих сонных артерий.
Эксперименты на КЗН мозжечка показали, что в 7-суточных культурах, не обработанных глутаматом, при воздействии церебролизина с цитратом лития выживаемость нейронов не изменяется по сравнению с контролем.
В модели глутаматного воздействия (250 мкМ глутамата) в контрольной группе выживало 20,0±4,0% нейронов. Добавление комбинации церебролизина с цитратом лития повышало выживаемость нейронов до 61,2±3,6% при концентрации лития 0,1 мМ и до 82,2±4,2% при концентрации лития 1 мМ. Таким образом, смесь церебролизина и цитрата лития при концентрациях лития 0,1—1,0 мМ дозозависимо защищает нейроны в культуре от токсического действия глутамата (рис. 7, рис. 8).
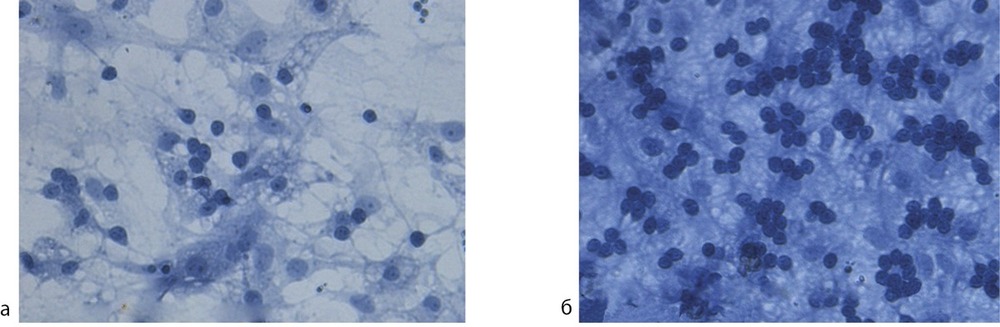
Рис. 7. Воздействие церебролизина на выживание нейронов в культуре при токсическом воздействии глутамата. а — глутамат, 250 мкмоль/л.
Отмечается небольшое число выживших зернистых нейронов; б — клетки выращивались в комбинации церебролизина, 1 мл/л и цитрата лития, 1 ммоль/л в течение 5 сут, затем проведена обработка глутаматом, 250 мкмоль/л. Видно большее количество выживших зернистых нейронов с нормальной морфологией.
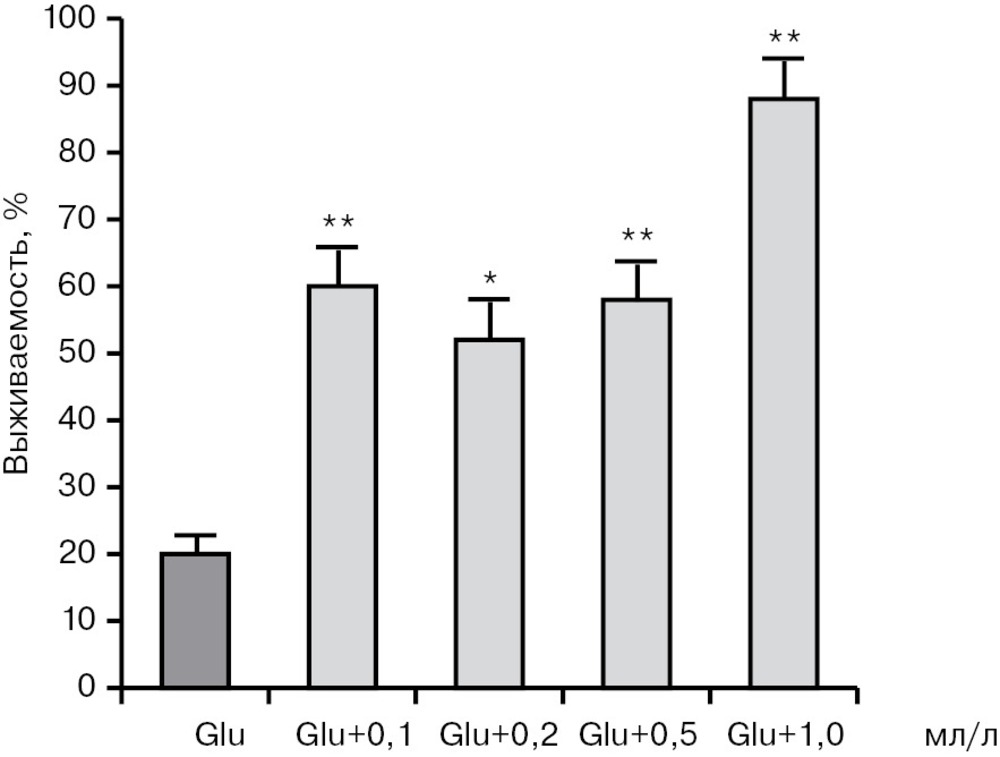
Рис. 8. Влияние смеси легкой пептидной фракции церебролизина с цитратом лития на выживание нейронов при токсическом воздействии глутамата (250 мкМ).
Количество просчитанных полей зрения n=15. По оси абсцисс указаны концентрации лития в ммоль/л, которые также соответствуют концентрациям церебролизина в мл/л. *р<0,05, **p<0,01 по сравнению с действием глутамата без добавок (слева).
Несмотря на обилие публикаций по исследованию нейропротекторов и нейротрофических свойств лития, взаимодействия между литием и такими нейропептидами, как ФРН, энкефалины, орексин и галанин, остаются малоизученными. Известно, что литий повышает содержание ФРН, мозгового нейротрофического фактора и глиальных клеток в гиппокампе, фронтальной коре, затылочной коре и полосатом теле [27, 28]. Повышение концентрации хлорида лития в питьевой воде приводило к повышению его концентрации в сыворотке крови до 0,72±0,08 ммоль/л, что было ассоциировано с увеличением концентрации ФРН в лобной коре (на 23%), гиппокампе (на 72%), миндалевидном теле (на 74%) и лимбическом переднем мозге (на 47%) (р<0,05) [29].
На синергизм между литием и ФРН может указывать тот факт, что литий повышает размеры транспортных пузырьков в нейронах, которые претерпели дифференциацию именно под воздействием ФРН. В обработанных литием клетках отмечено значительное увеличение их количество (в 1,5—2 раза) и диаметра (примерно на 15%) [30].
В эксперименте внутрибрюшинное введение лития (4 ммоль/кг в течение 6 сут) повышает уровни энкефалинов в базальных ганглиях крыс [31]. Воздействие лития на энкефалиновые сигнальные системы требует соблюдения оптимального интервала дозирования. Диета с меньшим содержанием лития приводила к повышению его уровня в мозге до 0,40—0,55 ммоль/л, а диета с более высоким его содержанием — к повышению до 0,70—1,0 ммоль/л. При диете с меньшим содержанием лития, через 3 нед было отмечено его достоверное по сравнению с контролем повышение. После 3 нед диеты с низким содержанием лития уровень лейцин-энкефалина в бледном шаре и в nucleus accumbens повышался. При диете с более высоким содержанием лития, повышения уровней лейцин-энкефалина не наблюдалось [32].
Ионы лития могут участвовать в регуляции сродства опиоидных рецепторов к энкефалинам [33]. Кроме того, гликогенсинтазы-киназа 3b (GSK-3b) — основной фермент, опосредующий нейропротективные эффекты лития, ингибируется как ионами лития, так и агонистами дельта-опиоидных рецепторов. Ингибирование GSK-3b ионами лития и агонистами дельта-опиоидных рецепторов осуществляется посредством фосфорилирования GSK-3b, что соответствует активации сигнальных путей клеточного выживания [34]. Таким образом, имеющиеся данные позволяют предполагать, что установленный нами синергичный эффект между ионами лития и нейропептидами церебролизина обусловлен эффектами ФРН и энкефалинов.
Заключение
В работе впервые установлено существование нейропротективного и нейротрофического синергизма между ионами лития и нейропептидами церебролизина. Фармакокинетический синергизм заключается в ускоренном накоплении лития в тканях головного мозга под воздействием пептидов церебролизина. Иначе говоря, нейропептиды церебролизина потенцируют таргетную доставку ионов лития в мозг и усвоение их нейронами. Существование фармакодинамического синергизма между литием и нейропептидами церебролизина вытекает из всего комплекса проведенных нами экспериментальных, нейроцитологических, гистоморфологических исследований и анализа микроэлементного профиля биосубстратов мозга. Ранее нами было установлено, что в состав легкой пептидной фракции церебролизина входят активные фрагменты ФРН и энкефалины. Вероятные клеточные механизмы осуществления исследуемого синергизма между литием и пептидами церебролизина включают повышение литием размеров и числа больших транспортных везикул, необходимых для секреции моноаминов и других нейротрансмиттеров в нейронах под воздействием ФРН; повышение литием аффинитета опиоидных рецепторов к энкефалинам; совместное ингибирование литием и энкефалинами GSK-3b.
ЛИТЕРАТУРА
1. Торшин И.Ю., Громова О.А. Экспертный анализ данных в молекулярной фармакологии. М: МЦНМО 2012; 684.
2. Ижбульдина Г.И. Изменения системного гомеостаза и свободно-радикального окисления липидов в острой стадии ишемического инсульта. Журн неврол и психиат 2012; 112: 3: 31—37.
3. Chen C., Wei S., Tsaia S., Chen X., Cho D. Cerebrolysin enhances cognitive recovery of mild traumatic brain injury patients: double-blind, placebocontrolled, randomized study. Br J Neurosurg 2013; 27: 6: 803—807.
4. Хабиров Ф.А., Хайбуллин Т.И., Григорьева О.В. Комплексный подход к реабилитации пациентов, перенесших инсульт с двигательными расстройствами в ранний реабилитационный период. Журн неврол и психиат 2011; 111: 4: 32—36.
5. Шамалов Н.А., Стаховская Л.В., Буренчев Д.В., Кичук И.В., Творогова Т.В., Боцына А.Ю., Смычков А.С., Кербиков О.В., Меслер Х., Новак П., Скворцова В.И. Журн неврол и психиат 2010; 110: 12: 34—37.
6. Садин А.В., Жидоморов Н.Ю., Гоголева И.В., Демидов В.И., Гришина Т.Р., Громова О.А. Исследование нейрорегенеративного действия препарата Церебролизин при травматическом повреждении головного мозга. Журн неврол и психиат 2013; 113: 4: 57—60.
7. Vazquez-Roque R., Ubhi K., Masliah E., Flores G. Chronic cerebrolysin administration attenuates neuronal abnormalities in the basolateral amygdala induced by neonatal ventral hippocampus lesion in the rat. Synapse 2014; 68: 1: 31—8.
8. Georgy G., Nassar N., Mansour H., Abdallah D. Cerebrolysin Ameloriates Cognitive Deficits in Type III Diabetic Rats. PLoS One 2013; 8: 6: 64847.
9. Громова О.А., Третьяков В.Е., Мошковский С.А., Гусев Е.И., Никонов А.А., Валькова Л.A., Глибин А.C., Катаев А.С. Олигопептидная мембранная фракция церебролизина. Журн неврол и психиат 2006; 106: 7: 68—70.
10. Громова О.А., Красных Л.М., Гусев Е.И., Никонов А.А. Витаминная активность церебролизина. Журн неврол и психиат 2005; 105: 5: 59—61.
11. Торшин И.Ю., Громова О.А., Тогузов Р.Т., Волков А.Ю. Элементный состав нейропротекторов природного происхождения. Новости медицины и фармации. Неврология 2010; 316: 23—27.
14. Sharifzadeh M., Aghsami M., Gholizadeh S., Tabrizian K., Soodi M., Khalaj S., Ranjbar A., Hosseini-Sharifabad A., Roghani A., Karimfar M. Protective
effects of chronic lithium treatment against spatial memory retention deficits induced by the protein kinase AII inhibitor H-89 in rats. Pharmacology 2007; 80: 2—3: 158—165.
15. Lyoo I., Dager S., Kim J., Yoon S., Friedman S., Dunner D., Renshaw P. Lithium-induced gray matter volume increase as a neural correlate of treatment response in bipolar disorder: a longitudinal brain imaging study.Neuropsychopharmacol 2010; 35: 8: 1743—1750.
16. Гоголева И.В. Влияние органических солей лития, магния, селена на элементный гомеостаз головного мозга на фоне экспериментальной
хронической окклюзии общих сонных артерий: Автореф. дис. канд. мед. наук. М 2009; 23.
17. Gold A., Herrmann N., Lanctot K. Lithium and its neuroprotective and neurotrophic effects: potential treatment for post-ischemic stroke sequelae.
Curr Drug Targets 2011; 12: 2: 243—255.
18. Громова О.А., Кудрин А.В., Катаев С.И., Мазина С.С., Волков А.Ю. Влияние церебролизина на микроэлементный гомеостаз головного мозга. Журнал неврологии и психиатрии, 11, 2003, 59—61.
19. Combs D.J., D’Alecy L. Functional Assessment After Cerebral Ischemia. Stroke 1987; 18: 2: 503—511.
20. Багмето в М.Н. Церебропротективное действие композиций фенибута и фенотропила и их солей в условиях экспериментальной ишемии головного мозга: Автореф. дис. ... д-ра мед. наук. Волгоград 2006.
21. Кейтс М. Техника липидологии. М: Мир 1975; 322.
22. Дарбре А. Практическая химия белка. М: Мир 1989;: 621.
23. Лохов П.Г., Ипатова О.М., Прозоровский В.Н. Пептидный аналог аполипопротеина е усиливает клиренс липопротеинов и снижает уровень сывороточного холестерина. Вопросы медицинской химии 2001; 2: 23—27.
24. Nordhoff E., Schurenberg M., Thiele G., Lubbert C., Kloeppel K.-D., Theiss D., Lechrach H., Goborn J. Sample preparation protocols for MALDI-MS
of peptides and oligonucleotides using prestructuredsample supports. Int Jornal of Mass Spectrom 2003; 226: 163—180.
25. Hutter-Paier В., Grygar E., Windisch M. Death of cultured telencephalon neurons induced by glutamate is reduced by the peptide derivate Cerebrolysin. J Neural Transm, 1996, [Suppl] 47: 267—273.
26. Громова О.А., Скальный А.В., Панасенко О.М. Стуктурный анализ и ферментативная антиокислительная активность нейрометаболических препаратов природного происхождения: церебролизина, церебролизата, билобила и актовегина. Микроэлементы в медицине, 2 (1): 23—27.
27. Frey B., Andreazza A., Rosa A., Martins M., Valvassori S., Reus G., Hatch J., Quevedo J., Kapczinski F. Lithium increases nerve growth factor levels in the
rat hippocampus in an animal model of mania. Behav Pharmacol 2006; 17: 4: 311—318.
28. Angelucci F., Aloe L., Jimenez-Vasquez P., Mathe A. Lithium treatment alters brain concentrations of nerve growth factor, brain-derived neurotrophic factor and glial cell line-derived neurotrophic factor in a rat model of depression. Int J Neuropsychopharmacol 2003; 6: 3: 225—231.
29. Hellweg R., Lang U., Nagel M., Baumgartner A. Subchronic treatment with lithium increases nerve growth factor content in distinct brain regions of adult rats. Mol Psychiatry 2002; 7: 6: 604—608.
30. Umbach J., Zhao Y., Gundersen C. Lithium enhances secretion from large dense-core vesicles in nerve growth factor-differentiated PC12 cells. J Neurochem
2005; 94: 5: 1306—1314.
31. Sivam S., Takeuchi K., Li S., Douglass J., Civelli O., Calvetta L., Herbert E., McGinty J., Hong J. Lithium increases dynorphin A(1—8) and prodynorphin
mRNA levels in the basal ganglia of rats. Brain Res 1988; 427: 2: 155— 163.
32. Staunton D., Deyo S., Shoemaker W., Ettenberg A., Bloom F. Effects of chronic lithium on enkephalin systems and pain responsiveness. Life Sci
1982; 31: 16—17: 1837—1840.
33. Byck R. Peptide transmitters: a unifying hypothesis for euphoria, respiration, sleep, and the action of lithium. Lancet 1976; 2: 7976: 72—73.
34. Plotnikov E., Grebenchikov O., Babenko V., Pevzner I., Zorova L., Likhvantsev V., Zorov D. Nephroprotective effect of GSK-3beta inhibition by lithium
ions and delta-opioid receptor agonist dalargin on gentamicin-induced nephrotoxicity. Toxicol Lett 2013; 220: 3: 303—388.
Источник: Журнал неврологии и психиатрии им. С.С. Корсакова, № 3, 2015
